心肌肥厚是心力衰竭和心脏性猝死的重要病理性因素。尽管临床广泛使用的肾素-血管紧张素-醛固酮系统抑制剂、β受体抑制剂可在一定程度上逆转心肌肥厚,但目前由心肌肥厚导致的心力衰竭发病率和病死率仍然居高不下,因此新药物的研发有望为心肌肥厚的治疗提供新思路[1]。我们的前期研究显示花生四烯酸的代谢产物环氧二十碳三烯酸(EET)具有改善心肌肥厚的作用,但其机制目前尚未完全清楚[2]。心肌细胞凋亡在心肌肥厚的进展中发挥着重要的作用,那么EET能否通过抑制心肌细胞凋亡进而抑制心肌肥厚,目前仍未明确。在本研究中,笔者拟通过使用可溶性表氧化物水解酶(sEH)抑制剂提升体内EET水平进而探讨其改善心肌肥厚的机制。
材料与方法 一、实验动物SPF级雄性SD大鼠18只,6周龄,180~200 g,由中山大学动物实验中心提供。H9C2心肌细胞系购自美国菌种保藏中心(ATCC)。药品与试剂:盐酸异丙肾上腺素(ISO)注射针剂(大连美仑生物技术有限公司),sEH抑制剂TUPs由中山大学孙逸仙纪念医院黄辉课题组惠赠。Caspase 3抗体(Abcam),兔源性二抗(Santa Cruz)。原位缺口末端标记法(TUNEL)试剂盒(Promega,Madison,USA)。
二、方法 1. 实验动物模型建立和分组采用随机数字表法将雄性SD大鼠分为3组各6只,分别为对照组(control组)、模型组(ISO组)、sEH抑制剂干预组(ISO+TUPs组)。ISO组大鼠皮下注射ISO 1 mg/ (kg·d)连续14 d以建立心肌肥厚模型。ISO+TUPs组每日加予口服sEH抑制剂TUPs 0.65 mg/ (kg·d),连续14 d。本研究遵循实验动物伦理相关规定。
2. 心脏与体质量比值测定末次给药后禁食12 h,称体质量后安乐处死大鼠,取出心脏称其质量。心脏与体质量比值=心脏质量(mg)/体质量(g)。
3. 实时荧光定量PCR按照Trizol RNA plus说明书提取组织总RNA,使用PrimeScriptTM RT Master Mix试剂盒(TaKaRa公司)进行逆转录合成cDNA,并用SYBR GreenⅡ,按两步法(95 ℃、60 ℃)进行扩增及检测,每次3个复孔,总RNA每孔500 μg。心肌细胞肥大指标心房利钠肽(ANP)引物为:GGAGCCTGCGAAGGTCAA;TATCTTCGGTACCGGAAGCTGT;β-actin引物为:CAGATCATGTTTGAGACCTTCAA;GTGGTA-CGACCAGAGGCATACA。
4. 心肌组织凋亡检测采用TUNEL按照试剂盒说明书操作,用二甲苯浸洗2次,每次5 min;用梯度乙醇(100%、95%、90%、80%、70%)各浸洗1次,每次3 min;用磷酸盐缓冲液(PBS)漂洗2次;用Proteinase K工作液处理组织20 min,用PBS漂洗3次,各5 min;加50 μl TUNEL反应混合液于标本上,于37 ℃下加封口膜在暗湿盒中反应60 min。用PBS漂洗3次,各5 min。于含辣根过氧化物酶的抗荧光素抗体37 ℃湿盒中避光30 min,用PBS漂洗3次,各5 min,用3,3-二氨基联苯胺(DAB)显色5~10 min,用PBS漂洗3次,各5 min,用苏木素复染细胞核数秒,流水冲洗,脱水,透明,中性树胶封片。心肌细胞凋亡率=凋亡心肌细胞/心肌细胞总数×100%。
5. 免疫组织化学检查(免疫组化)将心肌组织的石蜡切片脱蜡至水,加入3% H2O2室温孵育10 min,用蒸馏水冲洗,PBS浸泡5 min 2次,用10%正常山羊血清封闭,室温孵育10 min,弃去血清,滴加Caspase 3一抗(Abcam 1: 50)工作液,于37 ℃孵育1 h。用PBS冲洗3次各5 min,滴加生物素标记兔源性二抗(Santa Cruz 1: 100)工作液,于37 ℃孵育20 min。用PBS冲洗3次各5 min,滴加适量的辣根酶工作液,于37 ℃孵育20 min。用PBS冲洗3次各5 min,用DAB显色剂显色5 min,用自来水充分冲洗,复染,脱水,透明,封片。
三、统计学处理使用SPSS 20.0处理数据,计量资料采用x±s表示,计数资料采用率或构成比表示,组间比较用单因素方差分析,使用LSD-t检验进行两两比较。P<0.05为差异有统计学意义。
结果 一、sEH抑制剂TUPs对ISO所致心肌肥厚的影响14 d后3组间心脏质量比较差异有统计学意义(F=10.557,P=0.004)。其中,ISO组心脏质量与体积均较control组重/大,而这一作用可以被sEH抑制剂TUPs所抑制。同时,ISO也增加心脏与体质量比值(ISO组 vs. control组为8.650±0.768 vs. 5.775±1.024,P=0.004),而TUPs可减低心脏与体质量比值(ISO+TUPs组 vs. ISO组为6.475±0.957 vs. 8.650±0.768,P=0.012),见图 1A、B。3组间ANP表达不全相同(F=113.375,P<0.001),其中ISO增加ANP的表达(ISO组 vs. control组为2.152±0.154 vs.1.037±0.039,P<0.001),而TUPs可以降低ISO诱导的ANP的表达(ISO+TUPs组 vs. ISO组为1.470± 0.909 vs. 2.152±0.154,P=0.006),见图 1C。

|
图 1 control、ISO、ISO+TUPs组心脏大体形态、心脏与体质量比值、ANP表达 A:3组心脏外观;B:3组心脏与体质量比值;C:3组ANP的表达,2组间比较,*P<0.05 |
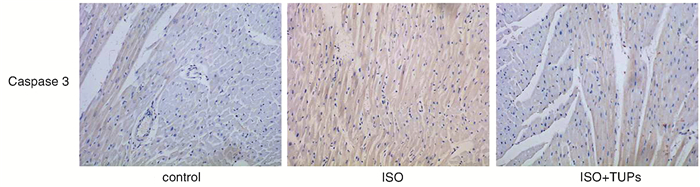
TUNEL染色结果提示3组间心肌细胞的凋亡率有差异(F=133.533,P<0.001)。ISO增加了心肌细胞的凋亡率[ISO组 vs. control组为(1.258±0.059)% vs. (0.431±0.098)%,P=0.019)],而TUPs可以减少ISO所致的心肌细胞凋亡率[ISO+TUPs组 vs. ISO组为(0.710±0.052) % vs.(1.258±0.059) %,P=0.018],见图 2。另外,3组Caspase 3的表达比较差异有统计学意义(F=44.675,P<0.001),ISO增加了Caspase 3的表达(ISO组 vs. control组为1.837±0.187 vs. 0.999±0.084,P=0.004),而TUPs抑制了ISO诱导的Caspase 3的表达(ISO+TUPs组 vs. ISO组为1.397 ±0.071 vs. 1.837±0.187,P=0.033),见图 3。

|
图 2 control、ISO、ISO+TUPs组心肌细胞凋亡水平 A:TUNEL染色;B:心肌细胞凋亡率,2组间比较,*P<0.05 |
|
图 3 control、ISO、ISO+TUPs组凋亡蛋白Caspase 3表达情况(×100) |
我们的在体实验证明了sEH抑制剂TUPs能显著改善ISO所致的心肌肥厚,这一效应可能与TUPs抑制ISO所致的心肌细胞凋亡有关。心肌肥厚是心脏为适应各种刺激如压力增大、容量超负荷、神经内分泌因子过渡激活等产生的病理改变,表现为心肌细胞肥大、外基质重建等。早期改变是机体发生的适应性改变,但到晚期,心脏发生失代偿,最终可以引发心力衰竭、心脏性猝死等严重的心血管事件。尽管心肌肥厚的问题已被临床广泛关注,但目前仍没有很有效的药物可逆转心肌肥厚。EET是新近发现的具有多种生物活性的花生四烯酸代谢产物[3]。sEH是EET分解代谢的主要代谢酶之一,通过抑制sEH可以提升EET水平,进而发挥一系列心血管保护作用。有研究显示,在自发高血压心力衰竭大鼠和慢性心力衰竭患者中,其心脏局部14, 15-环氧化二十碳(14, 15-DHET)、sEH蛋白水平和基因水平表达下降,同时该研究显示编码sEH的基因EPHX2是心力衰竭易感基因[4]。在AngⅡ诱导的心肌肥厚模型中,Ai等[5]证明AngⅡ可以增加sEH蛋白的表达,应用sEH抑制剂可以改善AngⅡ所造成的心肌肥厚。
细胞凋亡是由细胞内外各种因素触发细胞内预存的死亡程序而引起细胞死亡的一种方式。在正常的心肌组织中,心肌细胞的凋亡率非常低,但既往研究均证实心肌肥厚的过程中心肌细胞凋亡率会以几个数量级增加[3]。在本研究中,我们也发现在ISO所致的心肌肥厚的过程中,凋亡心肌细胞数量增加,同时凋亡蛋白Caspase 3表达也增加,但这些作用可以被sEH抑制剂TUPs抑制,故提示EET可以通过抑制心肌细胞凋亡进而改善心肌肥厚。但EET是如何抑制凋亡的仍需作进一步探讨。有研究证实在缺氧和复氧的情况下,EET可以降低心肌Caspase 3的活性从而保护心脏[6]。而这一保护作用依赖于PI3K信号通路的激活。同样Dhanasekaran等[7]也证明EET抗凋亡作用可能是通过影响PI3K下游的效应分子,例如Akt,Bcl-xl/Bcl-2相关死亡启动子BAD和凋亡蛋白Caspase 9和Caspase 3而实现的。
综上所述,本研究结果提示了sEH抑制剂TUPs可以通过抑制ISO所致心肌细胞的凋亡进而改善心肌肥厚,本研究结果可为心肌肥厚的治疗提供新的思路。
| [1] |
郭文玉, 王小庆, 徐验, 邹春霞, 杨碧芳, 余丹青. 阿托伐他汀对射血分数保留心力衰竭患者YKL-40及心功能的影响[J]. 新医学, 2014, 45(3): 169-172. |
| [2] |
Zhang H, Wang T, Zhang K, Liu Y, Huang F, Zhu X, Liu Y, Wang MH, Tang W, Wang J, Huang H. Deletion of soluble epoxide hydrolase attenuates cardiac hypertrophy via down-regulation of cardiac fibroblasts-derived fibroblast growth factor-2[J]. Crit Care Med, 2014, 42(5): e345-e354. DOI:10.1097/CCM.0000000000000226 |
| [3] |
Zhang K, Wang J, Zhang H, Chen J, Zuo Z, Huang H. Mechanisms of epoxyeicosatrienoic acids to improve cardiac remodeling in chronic renal failure disease[J]. Eur J Pharmacol, 2013, 701(1-3): 33-39. DOI:10.1016/j.ejphar.2012.12.025 |
| [4] |
Wang ZH, Davis BB, Jiang DQ, Zhao TT, Xu DY. Soluble epoxide hydrolase inhibitors and cardiovascular diseases[J]. Curr Vasc Pharmacol, 2013, 11(1): 105-111. DOI:10.2174/157016113804547593 |
| [5] |
Ai D, Pang W, Li N, Xu M, Jones PD, Yang J, Zhang Y, Chiamvimonvat N, Shyy JY, Hammock BD, Zhu Y. Soluble epoxide hydrolase plays an essential role in angiotensin Ⅱ-induced cardiac hypertrophy[J]. Proc Natl Acad Sci U S A, 2009, 106(2): 564-569. DOI:10.1073/pnas.0811022106 |
| [6] |
Qu YY, Yuan MY, Liu Y, Xiao XJ, Zhu YL. The protective effect of epoxyeicosatrienoic acids on cerebral ischemia/reperfusion injury is associated with PI3K/Akt pathway and ATP-sensitive potassium channels[J]. Neurochem Res, 2015, 40(1): 1-14. DOI:10.1007/s11064-014-1456-2 |
| [7] |
Dhanasekaran A, Gruenloh SK, Buonaccorsi JN, Zhang R, Gross GJ, Falck JR, Patel PK, Jacobs ER, Medhora M. Multiple antiapoptotic targets of the PI3K/Akt survival pathway are activated by epoxyeicosatrienoic acids to protect cardiomyocytes from hypoxia/anoxia[J]. Am J Physiol Heart Circ Physiol, 2008, 294(2): H724-H735. DOI:10.1152/ajpheart.00979.2007 |


