目前,结肠癌已成为世界第三高发肿瘤,在中国其致死率已达到第4位[1-2]。结肠癌的主要病理类型为结肠腺癌,人类大部分结肠腺癌呈现“早期癌前病变的异常隐窝灶(ACF) -腺瘤-腺癌”的发展规律[3]。在结肠癌研究中,使用氧化偶氮甲烷(AOM)这一致癌剂已成为啮齿类动物结肠癌化学诱导建模的主要方法之一[4-5]。但不同研究使用AOM的药物浓度及药物暴露时间不一,AOM对小鼠结肠肿瘤的诱导效果结论不一[6-7]。而在AOM基础上联合使用葡聚糖硫酸钠(DSS)这一促炎剂,在减少建模时间的同时可提高成瘤数量及体积。然而,不同的研究采用不同的DSS给药循环方案,报道的结肠癌成模效果/效率不一,尚未有研究比较DSS不同循环方案小鼠的成模效果/效率,以便研究者根据自己的研究需要选择合适的诱导方案并加以优化[8-9]。本实验拟研究C57BL/6J小鼠在单独给予不同剂量AOM或AOM联合不同循环方案的2%DSS在不同暴露时间下结肠癌的诱导效率,探寻较为合理的AOM及AOM/DSS给药的诱导方案,为研究结肠癌发生发展的化学诱导模型建立提供动物实验的比较数据,使研究者在根据自己的研究需要选择结肠癌化学诱导方案时有可循的科学研究基础,推动结肠癌发生发展相关的科学研究进展[9-10]。
材料与方法 一、主要试剂和动物AOM (Sigma公司,美国),DSS (分子量36000 -50000,MP Biomedicals公司,美国)。SPF级C57BL/6J小鼠,雄性,4周龄,256只。小鼠均由中山大学实验动物中心提供,饲养于中山大学实验动物中心,实验室环境温度为(23±3) ℃,相对湿度为(55±15) %,昼夜明暗交替时间为12 h/12 h。小鼠进行普通饮食,每3 d更换垫料,水和食物随时供应,饲料与垫料均由中山大学实验动物中心提供。所有有关动物的实验过程均在中山大学实验动物伦理委员会的监督指导下完成,符合实验动物伦理学要求。
二、主要方法 1. 造模及分组小鼠经适应性饲养1周(W)后,随机分别单独给予AOM或予AOM联合DSS诱导结肠癌。
对于单独给予AOM处理的小鼠,随机分成4组(低AOM、中AOM、高AOM及AOM对照组),每组24只,于W1、W2、W3、W4分别给予低、中、高浓度AOM (10 mg/kg、15 mg/kg、20 mg/kg)皮下注射,同期小鼠皮下注射0.1 ml/10 g生理盐水作为对照。每组分别于W5、W8、W11、W14随机各处死6只小鼠。
对于AOM联合DSS处理的小鼠,随机分为4组(DSS1、DSS2、DSS3及DSS对照组),小鼠于W1皮下注射10 mg/kg的AOM,1周后予2% DSS溶液自由饮用7 d,随后予正常饮用水2周。每1周DSS与2周正常饮用水为1个循环周期,DSS1、2、3组小鼠分别予以循环1次、2次、3次,小鼠数量分别为50只、41只、29只。DSS对照组有40只小鼠,于W1皮下注射0.1 ml/10 g生理盐水。DSS1组和DSS对照组分别于W5、W8、W11、W14随机各处死10只小鼠;DSS2组分别于W8、W11、W14随机各处死10只小鼠;DSS3组分别于W11、W14随机各处死10只小鼠。
2. 标本采集小鼠经颈椎脱臼法处死,沿腹中线打开腹腔,剪取自回盲部至直肠的肠段,使用预冷的PBS清洗肠道,沿长轴打开肠腔,仔细观察并触摸肠腔表面有无肿瘤形成。若结直肠未见肿瘤形成,则进行ACF的计数;若发现肿瘤形成,则进行肿瘤的计数观察。
3. ACF计数将肠道摊平并夹在两张滤纸之间,用2 g/L亚甲蓝染色20 min。肠道黏膜面向上,用光学显微镜在40×或100×观察条件下,计数每个完整结肠中ACF的数量。正常隐窝镜下呈类圆形,大小均匀,分布规则。ACF镜下可见多个隐窝的融合,较正常隐窝深染[5]。
4. 肿瘤计数和病理观察观察并记录其肿瘤的数量、大小、位置,测量并记录每个肿瘤的最长径和垂直短径。分别切取每个肿瘤及其癌旁组织和正常组织,4%多聚甲醛固定,进行石蜡包埋,制备组织切片,苏木素-伊红染色后,于光学显微镜下观察。按下述公式计算肿瘤体积、肿瘤发生率、平均成瘤数量和荷瘤小鼠平均成瘤数量:肿瘤体积= (最长径×垂直短径2)/2;肿瘤发生率(%) =荷瘤小鼠数量/实验小鼠数量×100%;平均成瘤数量=肿瘤数量/实验小鼠数量;荷瘤小鼠平均成瘤数量=肿瘤数量/荷瘤小鼠数量。
三、统计学处理采用SPSS 20.0分析。正态分布的定量资料用x±s表示,非正态分布的定量资料用中位数(四分位数间距)表示;率的比较使用Fisher确切概率法。多组正态分布的定量资料的均数比较用单因素方差分析,多个样本均数间的两两比较采用LSD-t检验;2组非正态分布的定量资料的比较用Wilcoxon秩和检验,多组非正态分布的定量资料的比较用Kruskal-Wallis法。总体比较P < 0.05即认为差异有统计学意义。平均秩次及率的两两比较用Bonferroni法,Bonferroni法以P < 0.05/比较次数为差异有统计学意义。
结果 一、不同AOM浓度和不同DSS循环周期对小鼠死亡率的影响低AOM组、中AOM组、高AOM组及AOM对照组均无小鼠死亡。DSS1组共有10只小鼠死亡,死亡率为20.00%;DSS2组共有11只小鼠死亡,死亡率为26.83%;DSS3组共有9只小鼠死亡,死亡率为31.03%;DSS对照组未见小鼠死亡。然而,AOM暴露浓度的增高和DSS循环周期的增加对小鼠的死亡率增长的影响并无统计学意义(P>均0.05)。
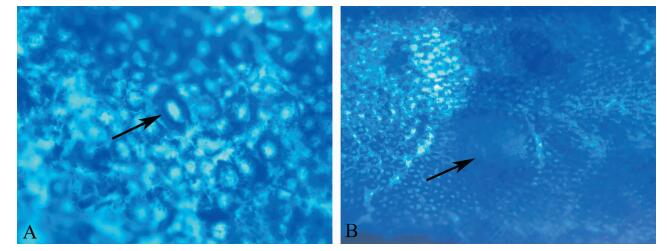
二、不同AOM浓度和暴露时间对小鼠ACF形成的影响同一暴露时间下,随着AOM浓度的增加,小鼠结肠ACF的平均数量增加(P均 < 0.05,表 1);同一暴露浓度下,随着AOM暴露时间的增加,小鼠结肠ACF的平均数量也可见增加(P均 < 0.001,表 1)。在开始AOM暴露的4周时,异常隐窝在镜下主要表现为单个隐窝的变化,可见隐窝体积增大,腺细胞膜增厚、染色加深(图 1A);随着暴露时间的增加,ACF的隐窝数量和体积均有所增加增大(图 1B)。
| 表 1 不同浓度AOM处理组小鼠结肠ACF的数量(x±s) |
|
图 1 小鼠结肠ACF的亚甲基蓝染色 A:箭头所示为中AOM组(15 mg/kg) W5时小鼠结肠形成的一个ACF,由单个隐窝构成,体积较正常隐窝增大,染色加深(×100);B:箭头所示为中AOM组(15 mg/kg) W14时小鼠结肠形成的一个ACF,由多个隐窝融合构成,染色加深,体积明显增大(×40) |
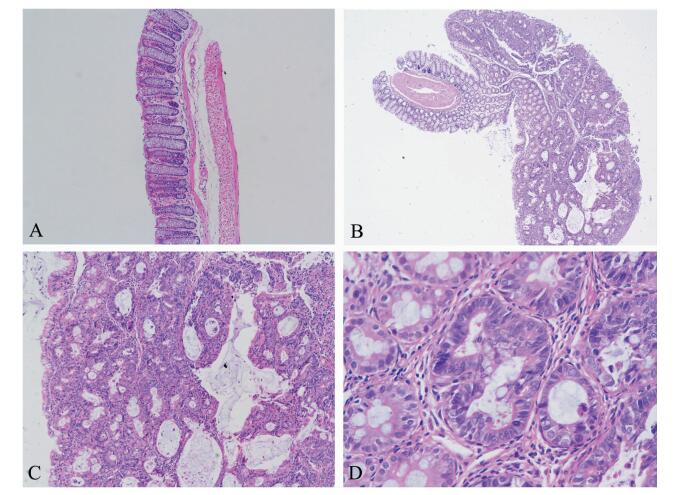
显微镜下观察,肿瘤为腺瘤伴高级别上皮内瘤变。与正常对照组相比,可见腺体排列紊乱、腺细胞大小不一、核大深染、核型不规则、病理性核分裂像等(图 2)。
|
图 2 AOM/DSS处理组中正常结肠组织和肿瘤组织的苏木素-伊红染色 A:正常小鼠结肠由黏膜层、黏膜下层、固有肌层和浆膜层构成。肠腺呈长管状,可见大量空泡状的杯状细胞(×40);B:腺瘤伴高级别上皮内瘤变。肿瘤呈外生性生长,腺体拥挤、排列紊乱,杯状细胞比例较正常减少。肿瘤腔面呈高级别上皮内瘤变改变,腺体更为拥挤紊乱,部分腺体丧失圆管状排列,呈不规则型。肿瘤边界清楚,未侵及黏膜肌层(×40);C:腺体排列紊乱,细胞异型伴核深染(×100);D:左侧腺体仍保持管状形态,由单层细胞构成,杯状细胞比例较正常腺体减低,细胞核大小较均一,未见病理性核分裂;右侧腺体丧失管状形态,腺体部分区域由多层细胞构成,未见正常的杯状细胞,细胞核较左侧腺体染色更深,细胞核大小不均,可见病理性核分裂现象(×400) |
AOM联合DSS可使小鼠结肠形成腺瘤伴高级别上皮内瘤变,相比DSS一循环,DSS二、三循环可显著增加肿瘤发生率、平均成瘤数量、荷瘤小鼠平均成瘤数量及肿瘤体积(P < 0.05或0.008),见表 2。
| 表 2 不同DSS循环周期对小鼠肿瘤形成的影响 |
AOM作为一种常用的结肠癌建模药物,可通过引起鸟嘌呤甲基化诱导突变损伤,促进啮齿类动物结肠癌模型的形成,其成癌过程也符合人类结肠癌80%发病的机制,即“正常肠黏膜-ACF-腺瘤-腺癌”的动态变化过程[1, 10-13]。在使用AOM的基础上加用DSS,可在化学药物致癌的基础上,重复诱导肠道上皮损伤与修复的慢性炎症状态,形成炎症相关性结肠癌模型,更可增加小鼠模型的成瘤效率,减少肿瘤形成时间[1, 10, 14-15]。由于目前文献报道的AOM及AOM/DSS相关动物实验采用不同的给药浓度及实验周期,对其实验结果进行评价分析则相对困难,本实验通过研究不同药物浓度、给药周期及暴露时间下,AOM和AOM联合DSS对C57BL/6J小鼠肠癌成模效果/效率的影响,探寻较为合理的诱导方案,提供结肠癌化学诱导模型动物实验的比较数据,在一定程度上为早期干预治疗肠癌的研究提供了新的思路和标准,具有较大的实验意义和价值[4, 6-9]。
ACF目前被认为是结直肠癌成癌过程中可在光镜下观察到的最小、最早期的结肠黏膜上皮的癌前病变,其发生被认为和最终的结肠肿瘤发生有着密切的关系[16]。在亚甲蓝染色的光镜观察下,ACF表现为腺管染色加深、面积增大;腺细胞上皮层增厚,细胞核的不典型增生现象[17]。AOM可通过诱导K-Ras、β-catenin等基因的突变诱发ACF形成,进而促进结肠癌的发生发展。本研究显示,小鼠肠道ACF的形成与注射的AOM剂量和总实验时间密切相关。随着AOM药物浓度的增加,小鼠结肠ACF的平均数量明显增加,提示在小鼠肠癌模型中,AOM既是肿瘤诱发剂,又起着肿瘤生长促进剂的作用。随着实验时间的增加,小鼠结肠ACF的平均数量显著增加,光镜下观察到的ACF也由单个隐窝细胞的深染、上皮层增厚,变为多个异常隐窝融合形成的增生灶,揭示了肠道癌前病变随着时间进展的发生发展情况。
DSS作为促炎剂,可抑制肠上皮细胞增生,影响细胞DNA合成,破坏肠黏膜屏障,导致巨噬细胞功能障碍及肠道菌群失调,反复诱导小鼠肠黏膜炎症形成[15]。在AOM的基础上联合DSS建模,可影响APC、β-catenin、K-Ras、COX-2、iNOS等基因,促进隐窝细胞增生,改变隐窝细胞正常代谢和胆汁酸肠肝循环,破坏肠道菌群生长平衡,最终诱发肿瘤形成[9]。本研究显示,AOM联合DSS建立的C57BL/6J小鼠模型中,其结肠肿瘤的病理类型为腺瘤伴高级别上皮内瘤变,病变尚未侵及黏膜下层,这或受实验时间所限。在采用1次10 mg/kg的AOM皮下注射结合DSS2循环的实验组中,W14的肿瘤发生率是W8的7倍;其平均成瘤数量是W8的14倍,平均成瘤数量的中位数也是W8的10倍,提示在该给药方案下,增加实验时间可有效增加成瘤效率。然而W11和W14的各项肿瘤评估指标未见统计学差异,这或提示在此方案下,小鼠肠癌模型存在诱导肿瘤生成的平台状态。
另外,在W11,DSS2或DSS3循环组较DSS1循环组的肿瘤发生率和荷瘤小鼠平均成瘤数量可见显著增加,且DSS3循环组较DSS2循环组的肿瘤体积也有明显增加,说明DSS循环周期的增加可显著提高AOM联合DSS方案的成瘤效果/效率。然而在W14,DSS3循环组较DSS2循环组未见上述指标的变化,这或提示与单独使用AOM的方案相似,AOM/DSS方案也存在诱导肿瘤生成的平台状态,在该平台状态,肿瘤数量不再增加,而是表现为体积的增大。
在本次共计14周的实验中,单独使用AOM并未形成结肠肿瘤,相同时间下AOM联合DSS则可诱发肿瘤生成,验证了AOM/DSS方案可有效提高结肠癌动物模型的成瘤效能,结直肠癌的发生发展是多因素、多步骤长期共同作用的结果,结肠的炎症损伤可明显提高致癌剂的致癌效率。此外,AOM各实验组未见小鼠死亡,提示小鼠对AOM的耐受性良好;DSS各实验组均有小鼠死亡,并主要发生在DSS饮水的一周内,但死亡率并无统计学差异,这或受较小的样本量所限。
综上所述,我们探讨了AOM或AOM联合DSS不同药物剂量、给药周期及暴露时间对建立结肠癌诱导模型效果的差异。我们认为,以ACF为目的和判断标准的AOM建模方案中,20 mg/kg AOM皮下注射,每周1次,共4周,W14中止实验为成本效益较佳的方案。以肿瘤形成及其数量体积为判断标准的AOM/DSS建模方案中,于W1对小鼠皮下注射1次10 mg/kg AOM,再分别于W2和W5给予2次持续7 d的2%DSS替换正常饮水后,于W11进行肠道取材,为成本效益较佳的实验方案。
| [1] |
De Robertis M, Massi E, Poeta ML, Carotti S, Morini S, Cecchetelli L, Signori E, Fazio VM. The AOM/DSS murine model for the study of colon carcinogenesis: from pathways to diagnosis and therapy studies. J Carcinog, 2011, 10: 9. DOI:10.4103/1477-3163.78279 |
| [2] |
Zheng R, Zeng H, Zhang S, Chen T, Chen W. National estimates of cancer prevalence in China, 2011. Cancer Lett, 2016, 370(1): 33-38. DOI:10.1016/j.canlet.2015.10.003 |
| [3] |
吕愈敏. 大肠癌癌前病变研究进展. 新医学, 2003, 34(7): 405-407. DOI:10.3969/j.issn.0253-9802.2003.07.002 |
| [4] |
Bissahoyo A, Pearsall RS, Hanlon K, Amann V, Hicks D, Godfrey VL, Threadgill DW. Azoxymethane is a genetic background-dependent colorectal tumor initiator and promoter in mice: effects of dose, route, and diet. Toxicol Sci, 2005, 88(2): 340-345. DOI:10.1093/toxsci/kfi313 |
| [5] |
Johnson RL, Fleet JC. Animal models of colorectal cancer. Cancer Metastasis Rev, 2013, 32(1-2): 39-61. DOI:10.1007/s10555-012-9404-6 |
| [6] |
Hata K, Kubota M, Shimizu M, Moriwaki H, Kuno T, Tanaka T, Hara A, Hirose Y. Monosodium glutamate-induced diabetic mice are susceptible to azoxymethane-induced colon tumorigenesis. Carcinogenesis, 2012, 33(3): 702-707. DOI:10.1093/carcin/bgr323 |
| [7] |
Saxena A, Shoeb M, Tammali R, Ramana KV, Srivastava SK. Aldose reductase inhibition suppresses azoxymethane-induced colonic premalignant lesions in C57BL/KsJ-db/db mice. Cancer Lett, 2014, 355(1): 141-147. DOI:10.1016/j.canlet.2014.09.006 |
| [8] |
Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M. IKKbeta links inflammation and tumorigenesis in a mouse model of colitis-associated cancer. Cell, 2004, 118(3): 285-296. DOI:10.1016/j.cell.2004.07.013 |
| [9] |
Tanaka T, Kohno H, Suzuki R, Yamada Y, Sugie S, Mori H. A novel inflammation-related mouse colon carcinogenesis model induced by azoxymethane and dextran sodium sulfate. Cancer Sci, 2003, 94(11): 965-973. DOI:10.1111/cas.2003.94.issue-11 |
| [10] |
Neufert C, Becker C, Neurath MF. An inducible mouse model of colon carcinogenesis for the analysis of sporadic and inflammation-driven tumor progression. Nat Protoc, 2007, 2(8): 1998-2004. DOI:10.1038/nprot.2007.279 |
| [11] |
王磊, 宋顺心, 汪建平. 结直肠癌实验研究现状及展望. 中华实验外科杂志, 2013, 30(3): 429-430. DOI:10.3760/cma.j.issn.1001-9030.2013.03.001 |
| [12] |
房静远. 关注结直肠腺瘤的诊治研究. 中华消化杂志, 2010, 30(7): 433-435. DOI:10.3760/cma.j.issn.0254-1432.2010.07.001 |
| [13] |
Suzuki R, Kohno H, Sugie S, Nakagama H, Tanaka T. Strain differences in the susceptibility to azoxymethane and dextran sodium sulfate-induced colon carcinogenesis in mice. Carcinogenesis, 2006, 27(1): 162-169. |
| [14] |
Tanaka T. Colorectal carcinogenesis: review of human and experimental animal studies. J Carcinog, 2009, 8: 5. DOI:10.4103/1477-3163.49014 |
| [15] |
Araki Y, Mukaisyo K, Sugihara H, Fujiyama Y, Hattori T. Increased apoptosis and decreased proliferation of colonic epithelium in dextran sulfate sodium-induced colitis in mice. Oncol Rep, 2010, 24(4): 869-874. |
| [16] |
Corpet DE, Taché S. Most effective colon cancer chemopreventive agents in rats: a systematic review of aberrant crypt foci and tumor data, ranked by potency. Nutr Cancer, 2002, 43(1): 1-21. DOI:10.1207/S15327914NC431_1 |
| [17] |
Ochiai M, Hippo Y, Izumiya M, Watanabe M, Nakagama H. Newly defined aberrant crypt foci as a marker for dysplasia in the rat colon. Cancer Sci, 2014, 105(8): 943-950. DOI:10.1111/cas.2014.105.issue-8 |



